0250319148
Nuovi catalizzatori per una moderna chimica verde: studio su Nature Catalysis
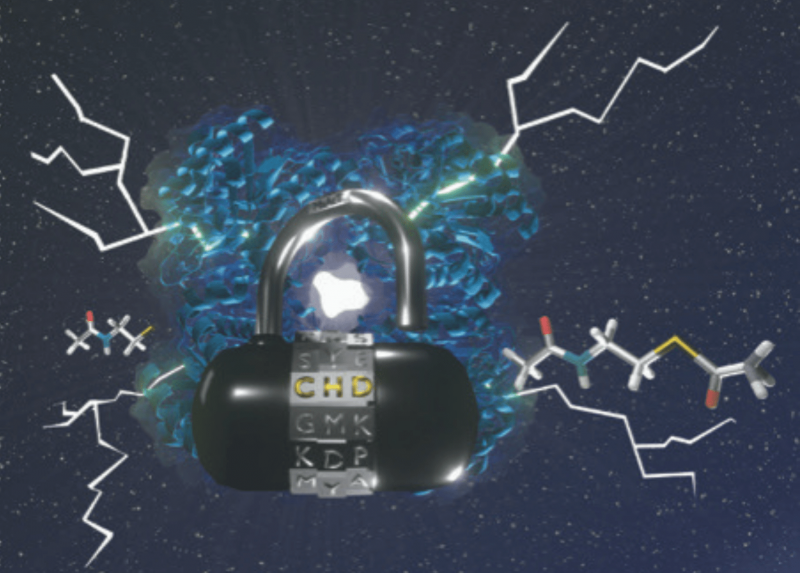
I gruppi di Francesco Molinari, chimico, docente del dipartimento di Scienze per gli Alimenti, la Nutrizione e l'Ambiente dell’Università degli Studi di Milano e di Francesca Paradisi, docente dell’Università di Berna hanno da poco pubblicato sulla rivista Nature Catalysis, del gruppo Nature, un lavoro che descrive l’ottenimento di un mutante di una aciltransferasi batterica per mutazione (uno scambio tra una serina con una cisteina) del sito attivo. Il nuovo catalizzatore è capace di promuovere la sintesi non solo di esteri e ammidi secondarie (come l’enzima originario), ma anche di tioesteri e ammidi terziarie. Lo studio mostra come le reazioni avvengono in unico passaggio in acqua, con una quantità limitata di catalizzatore e con rese e velocità elevate permettendo la realizzazione di reazioni su scala preparativa. In altre parole, la chimica realizzabile con questo nuovo mutante è considerevolmente amplificata.
“Questo lavoro – spiega il prof. Francesco Molinari - si configura all’interno di una moderna chimica verde e sostenibile dove la preparazione di enzimi che funzionano come catalizzatori versatili, stabili e produttivi è possibile attraverso mutazioni della loro struttura e selezione delle varianti che offrono le prestazioni desiderate, come dimostrato dal Premio Nobel per la Chimica attribuito a Frances Arnold nel 2018 per i suoi lavori sulla cosiddetta directed evolution”.
Per ampliare la gamma di substrati utilizzabili da un enzima o addirittura per modificarne la reattività, l'approccio è generalmente quello di mutare i residui coinvolti nel riconoscimento del substrato, sia attraverso mutazioni razionali o directed evolution, lasciando sempre intatti quelli catalitici. Uno degli assiomi della enzimologia riguarda infatti l’elevata conservazione degli amminoacidi catalitici in una data famiglia di enzimi; gli amminoacidi del sito attivo direttamente coinvolti nella modificazione di un substrato sono considerati infatti una sorta di firma del tipo di chimica che un enzima può realizzare. Conseguentemente, l'approccio ingegneristico è generalmente quello di mutare i residui coinvolti nel riconoscimento del substrato, sia attraverso la progettazione razionale o l'evoluzione diretta, lasciando sempre intatti quelli catalitici.
“In questo lavoro si è intervenuto invece proprio attraverso la semplice mutazione della serina catalitica, presente nel sito attivo di molte idrolasi e aciltransferasi, rimpiazzandola con una cisteina – prosegue Molinari -. Questo permette di ottenere una notevole riduzione dell'attività idrolitica a favore di quella sintetica rendendo il mutante un ottimo catalizzatore per la sintesi di molti derivati di acidi carbossilici. Tra i diversi esempi riportati, spicca la possibilità di preparare l’acetil-coenzima A, una molecola con un ruolo centrale nel metabolismo di zuccheri, proteine e lipidi; la sua preparazione in modo efficiente e sostenibile apre la possibilità al suo utilizzo come integratore alimentare. In definitiva, mentre la Natura ha costruito enzimi capaci sia di idrolizzare che sintetizzare derivati acilici, questa mutazione favorisce appieno la sintesi, rappresentando un utile strumento per i chimici che vogliono preparare prodotti di ogni tipo, incluse molecole di interesse alimentare e farmaceutico”.
Contatti
-
Francesco Enzo Molinari
Dipartimento di Scienze per gli Alimenti, la Nutrizione e l'Ambiente
Potrebbero interessarti anche
