3285414238
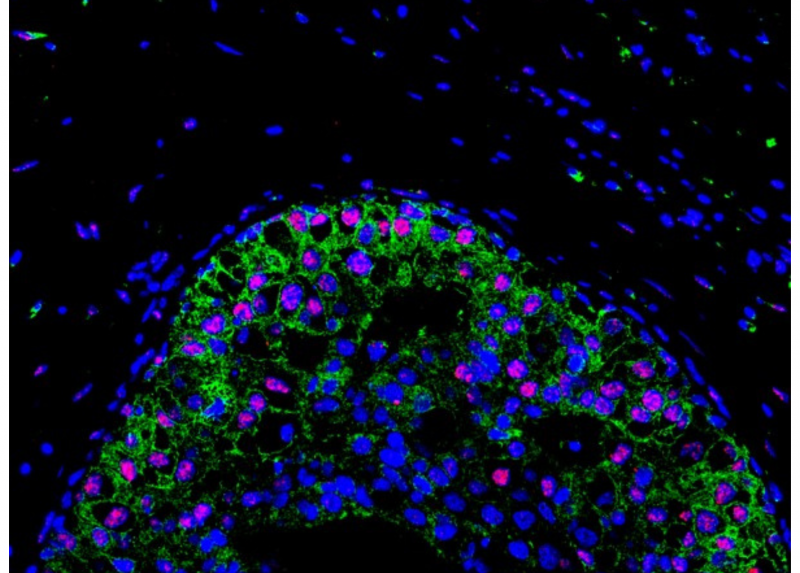
Immagini ottenute da analisi al microscopio confocale di fronti invasivi di carcinoma mammario derivati da campioni di pazienti. Lungo il fronte si può osservare l’aumento di espressione di RAB5A (verde) e l’accumulo di segnale di un marker di danno al DNA nucleare: γH2AX (in rosso). In blu il segn
Un gruppo di scienziati dell’IFOM - Istituto Fondazione di Oncologia Molecolare e dell’Università degli Studi di Milano ha individuato, negli stessi meccanismi molecolari che conferiscono alle cellule di carcinoma intraduttale mammario la capacità di acquisire proprietà invasive, la possibile chiave per rendere tali cellule paradossalmente più sensibili all’immunoterapia e per frenarne l’aggressività metastatica. La ricerca è stata possibile grazie all’integrazione di approcci e competenze di biologia molecolare, istopatologia e fisica dei materiali.
“Il carcinoma intraduttale mammario è diagnosticato sempre più facilmente grazie agli screening radiografici – spiega il professor Giorgio Scita, a capo del laboratorio ‘Meccanismi di ricerca delle cellule tumorali’ dell’IFOM e docente di Patologia Generale del dipartimento di Oncologia ed Emato-oncologia dell'Università Statale di Milano – e circa il 20% delle diagnosi di cancro al seno sono di questo tipo”. "Le cellule del carcinoma intraduttale si sviluppano e proliferano all’interno dei confini del dotto della ghiandola mammaria. In questa condizione di confinamento i tessuti sani circostanti comprimono la massa tumorale e ne alterano le proprietà fisiche, favorendone l’irrigidimento e prevenendone l’espansione. “Grazie a questo meccanismo di difesa – sottolinea Scita – per circa il 70% di questi tumori non sarebbe necessario alcun tipo di intervento né chirurgico né farmacologico, in quanto spesso regredirebbero spontaneamente. Solo il 30% circa progredisce, dando luogo a metastasi a distanza". La differenza, tuttavia, si osserva a posteriori poiché “a oggi, purtroppo, non ci sono strumenti – commenta Scita – per prevedere se una paziente rientrerà nel 30% o nel 70% dei casi". Di conseguenza tutte le pazienti a cui viene diagnosticato questo tipo di tumore sono sottoposte indistintamente alla stessa terapia, subendo effetti collaterali che per la maggior parte di loro sarebbe evitabile. "I medici – prosegue lo scienziato – non hanno a disposizione una chiave di lettura per capire come orientare le loro strategie terapeutiche in modo mirato o più semplicemente per risparmiare trattamenti non necessari. La sfida che ci siamo posti come gruppo di ricerca è stata di indagare le caratteristiche fisiche alla base delle due categorie di tumore, per cercare di indentificare criteri con cui differenziare i trattamenti e ridurre al minimo indispensabile le terapie applicate”.
Negli ultimi anni i ricercatori di IFOM e della Statale di Milano hanno messo in luce un aspetto precedentemente inesplorato di questo tipo di tumore. Esso presenta delle caratteristiche tali da potervi applicare le leggi fisiche che si utilizzano per studiare le proprietà dei materiali fluidi-soffici.
"In un nostro precedente studio - spiega Fabio Giavazzi, ricercatore di Fisica Applicata del dipartimento di Biotecnologie mediche e medicina traslazionale-, i cui risultati sono stati pubblicati nel 2019 sulla rivista Nature Materials, abbiamo individuato una proprietà meccanica e materiale specifica nelle cellule tumorali di quel 30% votato alla disseminazione metastatica. Si tratta della capacità del tessuto tumorale solido di diventare fluido. È un po’ come se il tumore fosse in grado di trasformarsi da una massa rigida ma inerte in un flusso liquido e mobile, riuscendo così a superare gli argini meccanici che ostacolavano la sua progressione e invasività. Avevamo inoltre constatato che la fluidificazione del tessuto tumorale è indotta dalla proteina RAB5A. Tale proteina regola la capacità delle cellule di internalizzare membrane e recettori ed è anche frequentemente espressa in quantità notevole proprio nei più aggressivi tumori al seno”.
Contatti
-
Giorgio Scita
Dipartimento di Oncologia ed Emato-Oncologia -
Fabio Giavazzi
Dipartimento di Biotecnologie Mediche e Medicina Traslazionale0250330322
0250330344
Potrebbero interessarti anche
